- وضعیت تومورهای مغزی در کودکان/ رویکرد درمان چند تخصصی
- این مواد غذایی خطر ابتلا به سرطان پروستات را کاهش میدهند
- تشخیص سه سرطان خطرناک فقط با یک نمونه خون + فیلم
- رازگشایی از ۷ علت ابتلا به سرطان/ این نقطه ایران بیشترین ابتلا به سرطان در دنیا را داشت
- درباره اولین واکسن نادرترین نوع سرطان چه میدانید؟
- متفورمین از داروی دیابت تا امید جدیدی برای درمان سرطان
- آیا مانیکور میتواند به سلامت ناخن آسیب برساند؟
- تفاوت ابتلا به سرطان در کودکان ایران و اروپا/ تلاش برای کاهش فاصله درمان
- تنهایی موجب کاهش طول عمر بازماندگان سرطان می شود
- اهمیت غربالگری سرطان های شایع در ایران/ آثار اقتصادی سرطان
- نحوه تاثیر آسپرین در پیشگیری از سرطان روده بزرگ
- خطری که بازماندگان سرطان سینه را تهدید میکند
- این روغن گیاهی تمام تومورهای مغزی و کل بدن را از بین میبرد
- تشخیص سرطان از یک قطره خون طی چند دقیقه
- راهکار ساده که شما را از ابتلا به سرطان در امان میدارد
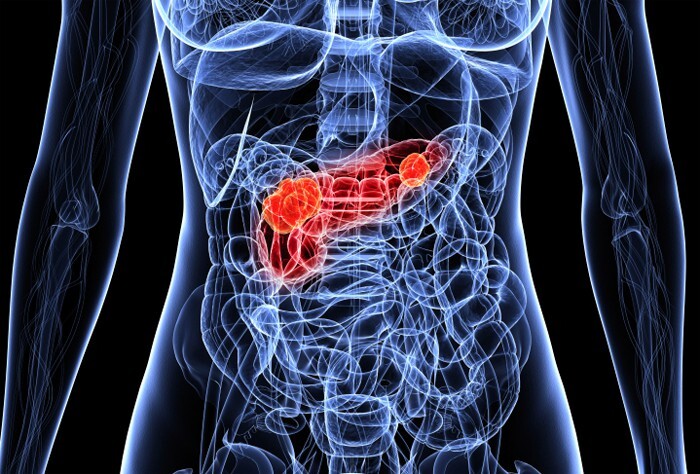
به گزارش سرطان نیوز، این دارو nimotuzumab است که به عنوان یک سرمایه گذاری مشترک چین و کوبا، یک آنتی بادی مونوکلونال که گیرنده فاکتور رشد اپیدرمی (EGFR) را هدف قرار میدهد، و سلولهای توموری را که EGFR را بیش از حد بیان میکنند، مهار میکند.
هنگامی که نیموتوزوماب به جمسیتابین اضافه شد، در آزمایشی که در چین روی ۹۲ بیمار مبتلا به سرطان پانکراس پیشرفته که KRAS wild type بودند، بقای کلی را در مقایسه با جمسیتابین به تنهایی بهبود بخشید. نرخ بقای یک ساله با نیموتوزوماب ۴۳.۶ ٪ در مقابل ۲۶.۸ ٪ با دارونما بود، در حالی که نرخ بقای ۳ ساله ۱۳.۹ ٪ در مقابل ۲.۷ ٪ بود. نتایج این مطالعه در نشست سالانه انجمن انکولوژی بالینی آمریکا (ASCO) ۲۰۲۲ ارائه شد.
بیشتر بخوانید:
داروی سرطان درمان قدرتمندی برای بیماری ام اس است
یکی از نویسندگان، Shukui Qin، MD، بخش انکولوژی پزشکی، مرکز سرطان بیمارستان Jinling، نانجینگ، چین، اظهار داشت: "ما معتقدیم آزمایش قابل توجه ما پیشرفتی در زمینه سرطان پانکراس خواهد بود. نتایج این کارآزمایی ممکن است امید جدیدی را برای بیماران مبتلا به سرطان پانکراس نوع KRAS wild type ایجاد کند. " دکتر کتی انج، کارشناس ASCO در سرطانهای دستگاه گوارش، میگوید: «مشاهده هرگونه مزیت بقا در آزمایش سرطان متاستاتیک پانکراس بسیار جالب توجه است" با این حال، او خاطرنشان کرد که زیر گروه بیمارانی که ممکن است سود ببرند کوچک هستند و تومورهای نوع KRAS wild type در کمتر از ۱۰ ٪ از بیماران مبتلا به سرطان پانکراس یافت میشوند. انج افزود: "مطالعات تکمیلی در مقایسه با ترکیب جمسیتابین/ناب-پاکلیتاکسل برای تأیید «هر گونه پیشرفت بالقوه برای ایجاد تفاوت واقعی در زندگی همه بیماران مبتلا به سرطان لوزالمعده» مورد توجه خواهد بود. "
Nimotuzumab در حال حاضر در چین به فروش میرسد: در سال ۲۰۰۸ توسط اداره ملی محصولات پزشکی چین برای درمان سرطان نازوفارنکس تایید شد و در حال حاضر در سرطانهای سر و گردن، دهانه رحم، مری و سایر سرطانها در حال بررسی است. Julie R. Gralow، MD، مسئول ارشد پزشکی ASCO و معاون اجرایی، در مصاحبهای با Medscape Medical News اظهار داشت که دیدن پاسخ سازمان غذا و داروی ایالات متحده [FDA]به دادههای فعلی جالب خواهد بود.
او توضیح داد که FDA اخیراً داروهای تولید و آزمایش شده در چین را رد کرده است، به صورت خاص سینتیلیماب (sintilimab) در سرطان ریه سلول غیر کوچک، زیرا دادههای بالینی ارائه شده از چین بوده و "منعکس کننده جمعیت سرطان ایالات متحده" نیست، و همچنین به این دلیل که در این مورد در حال حاضر تعدادی از داروهای مشابه دیگر در این زمینه درمانی موجود بوده است. با این حال، سرطان لوزالمعده نشان دهنده یک نیاز بالینی برآورده نشده است، که وضعیت متفاوتی دارد، و ممکن است در یک آزمایش بالینی در ایالات متحده، برای دریافت مجوزهای تسریع شده دور از انتظار نباشد.
او افزود: این کارآزمایی اثبات جالبی از فرضیه را نشان داد. نشان داد که یک مهارکننده EGRF در سرطان پیشرفته پانکراس نوع KRAS wild type دارای اثر درمانی است. این راه را برای اکتشاف داروهای دیگر باز میکند که به عنوان مهارکننده کنندههای EGFR نیز عمل میکنند، و همچنین داروهایی با سایر مکانیسمها مانند آنتاگونیستهای BRAF، مهارکنندههای MAP کیناز و/یا ایمونوتراپی.



 انجام سالانه ۲ میلیارد آزمایش پزشکی با حداقل خطا در کشور
انجام سالانه ۲ میلیارد آزمایش پزشکی با حداقل خطا در کشور