
- آنتیبیوتیکها تهدیدی در ابتلا به آسم هستند؟
- تولید ۱۰۹ تن عصاره و فرآورده گیاهان دارویی در هلالاحمر
- واردات محموله انسولین قلمی «نوومیکس» جهت رفع کمبود؛ بزودی
- مهمترین دلایل بروز مقاومتهای آنتیبیوتیکی / اغلب گلودردها بینیاز به آنتیبیوتیک
- اصالت سنجی زنجیره تأمین پلاسما/ برخورد با داروخانههای متخلف
- استفاده از نوشیدنی خنک حاوی کمی نمک برای گرمازدگی
- مصرف چه نوشیدنیهایی در تابستان توصیه میشود؟
- بدهکارترین بیمه به داروخانهها/ سازمان بازرسی ورود کرد
- چند نکته مهم درباره معجزه خوردن سالاد که نمی دانستید!
- غذای مناسب ویژه افرادی که مشکل معده دارند + فیلم
- توصیههای تغذیهای طب ایرانی برای تابستان / پرهیز از غذاهای با مزاج گرم در این فصل
- شرکتهای دارویی نتوانستهاند نقدینگی خود را تأمین کنند
- پایش میدانی عرضهکنندگان تجهیزات پزشکی/ بررسی اصالت کالا
- بیشترین مکملها و ویتامینهای مصرفی در کشور / هشدار مصرف بیش از حد در برخی بیماران
- گرما اشتهای افراد را نشانه گرفت
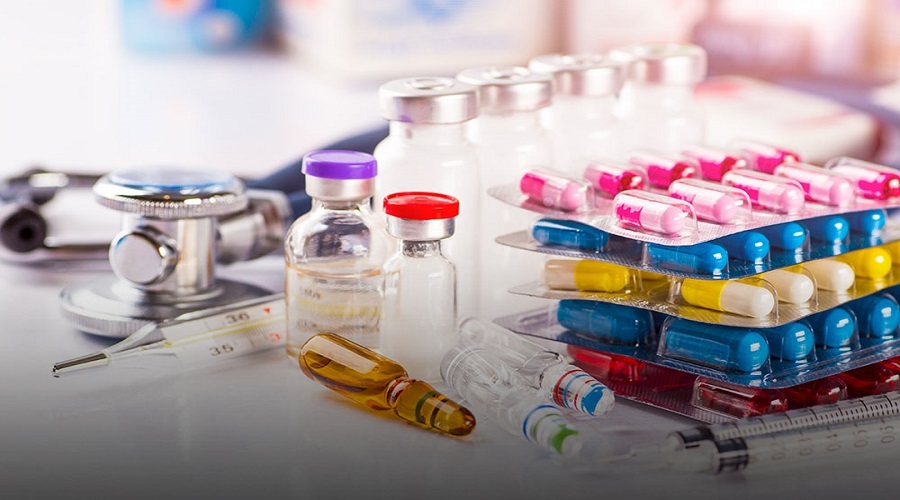 به گزارش گروه غذا و دارو سرطان نیوز، دکتر محمد پیکانپور گفت: با رفع عوامل بروکراتیک و تسهیل و سرعت بخشی به امورات تولیدکنندگان داخلی، ۴۴ خط جدید تولیدی و ۹۶ داروی جدید نظیر تراستوزومب امتانسین، سیستئامین، الترومبوپگ، اپرمیلاست، تیوتروپیوم استنشاقی، گوسلکومب، اتوپوزاید تزریقی، ایمیکیمود، ویگاباترین، ایربزارتان، تاکرولیموس تزریقی، لارونیداز، تراستوزومب دروکستکان، روپی واکائین، وینورلبین خوراکی، نیولومب، فولوسترانت، بوپی واکائین، پاپاورین تزریقی، رانیبیزومب و سیتارابین به بازار دارویی کشور عرضه شد.
به گزارش گروه غذا و دارو سرطان نیوز، دکتر محمد پیکانپور گفت: با رفع عوامل بروکراتیک و تسهیل و سرعت بخشی به امورات تولیدکنندگان داخلی، ۴۴ خط جدید تولیدی و ۹۶ داروی جدید نظیر تراستوزومب امتانسین، سیستئامین، الترومبوپگ، اپرمیلاست، تیوتروپیوم استنشاقی، گوسلکومب، اتوپوزاید تزریقی، ایمیکیمود، ویگاباترین، ایربزارتان، تاکرولیموس تزریقی، لارونیداز، تراستوزومب دروکستکان، روپی واکائین، وینورلبین خوراکی، نیولومب، فولوسترانت، بوپی واکائین، پاپاورین تزریقی، رانیبیزومب و سیتارابین به بازار دارویی کشور عرضه شد.
وی با اشاره به اینکه سال گذشته بیش از ۲۰۰ میلیون دلار از منابع ارزی برای خرید داروهای جدید تولید شده صرفه جویی شده است، گفت: به منظور احصا مشکلات صنعت، طی مدت کوتاهی از حدود دو سوم از شرکتهای داروسازی اصلی بازدید میدانی شد و اقدامات لازم جهت رفع چالشها در سطح اختیارات سازمان صورت پذیرفت.
بیشتر بخوانید
به گفته مدیرکل داروی سازمان غذا و دارو، ۵۶ مولکول جدید نیز طی ۱.۵ سال گذشته و پس از تایید شورای بررسی فهرست رسمی داروهای ایران وارد فهرست شدهاند که به عنوان نمونه میتوان به داروهایی نظیر کلادریبین، سیلودوسین، اتزولیزومب، سفتازیدیم-آوی باکتام، ودولیزومب، دورناز آلفا، انسولین رایزودگ و سولیکوا، توپوتکان، انزالوتاماید، پالیویزومب، رگورافینیب، اوزانیمود، فوسکارنت، ایبروتینیب، الاپاریب و اسیمرتینیب اشاره کرد و این در حالیست که در سال ۱۳۹۸ و ۱۳۹۹ داروی جدیدی وارد فهرست داروهای رسمی کشور نشده بود.
بنابر اعلام سازمان غذا و دارو، پیکانپور خاطرنشان کرد: با توسعه برون سپاری در برخی از اجراییات سازمان، تسریع قابل ملاحظه ای در روند اقدامات شرکت های دارویی صورت گرفته است که با ایجاد مسیر موازی "بررسی پرونده های ثبت" در خصوص پرونده های مشمول مسیربندی چهار و پنج، زمان انتظار ارزیابی و تایید این پرونده ها به کمتر از یک چهارم مدت قبل، کاهش پیدا کرده و شرکت های دارویی میتوانند بنا به درخواست خود، از مسیر موازی استفاده کنند.
منبع: ایسنا
 نسخه پزشکان برای وزیر بهداشت دولت چهاردهم/ نباید امتیاز بدهد
نسخه پزشکان برای وزیر بهداشت دولت چهاردهم/ نباید امتیاز بدهد


 واردات محموله انسولین قلمی «نوومیکس» جهت رفع کمبود؛ بزودی
واردات محموله انسولین قلمی «نوومیکس» جهت رفع کمبود؛ بزودی
 فرایند صدور گواهی تولد الکترونیک در بیمارستانها / تشکیل پرونده سلامت نوزاد با صدور کد ملی
فرایند صدور گواهی تولد الکترونیک در بیمارستانها / تشکیل پرونده سلامت نوزاد با صدور کد ملی









